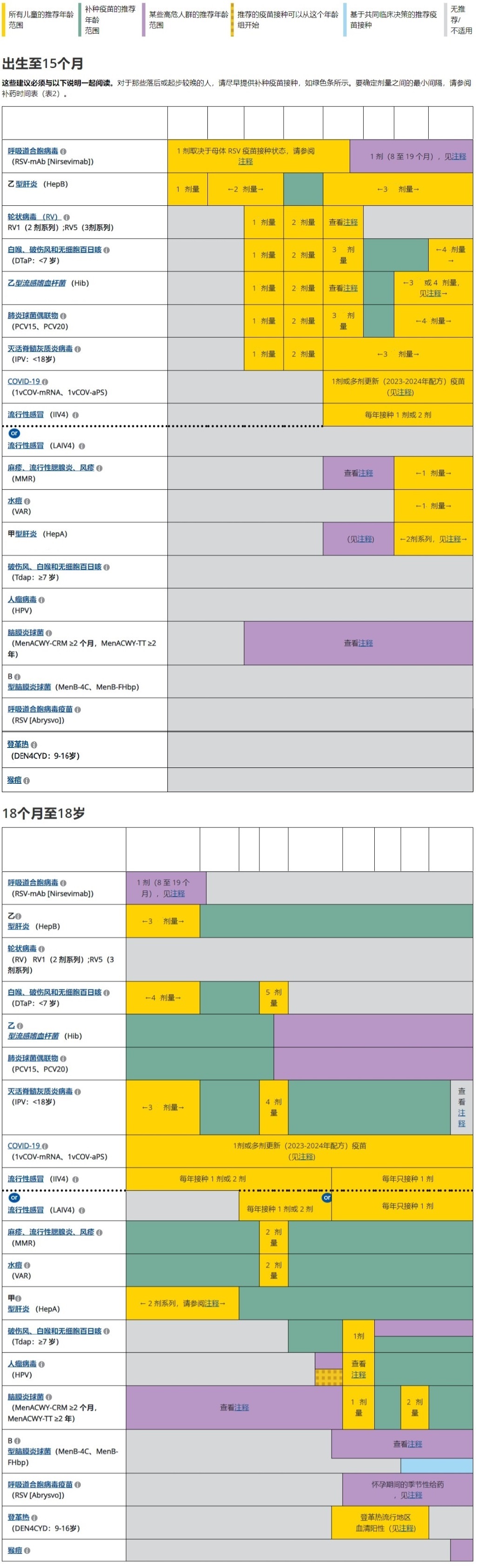
按年龄划分的儿童和青少年免疫接种计划
2024 年针对 18 岁或以下人群的建议,美国
说明
为起步较晚或落后 1 个月以上的儿童和青少年推荐的补种免疫计划
4 个月至 6 岁的儿童
|
疫苗 |
第 1 剂的最低年龄 |
剂量之间的最小间隔 |
|||
|---|---|---|---|---|---|
|
第 1 剂至第 2 剂 |
第 2 剂至第 3 剂 |
第 3 剂至第 4 剂 |
第 4 剂至第 5 剂 |
||
|
乙型肝炎 |
出生 |
4周 |
首次给药后 8 周和至少 16 周。 |
| |
|
轮状病毒 |
6周首次给药的最大年龄为 14 周零 6 天。 |
4周 |
|
| |
|
白喉、破伤风和无细胞百日咳 |
6周 |
4周 |
4周 |
6个月 |
6个月 |
|
乙型流感嗜血杆菌 |
6周 |
如果在 15 个月或以上时接种第一剂,则无需 |
如果先前的剂量是在 15 个月大或4 周 |
8 周(作为最终剂量) 此剂量仅适用于 12 至 59 个月的儿童,他们在 1 之前接种了 3 剂圣生日。 |
|
|
肺炎球菌偶联物 |
6周 |
如果第一剂是在 24 个月或以上 |
如果前一剂是在 24 个月或以上 |
8 周(作为最终剂量) |
|
|
灭活脊髓灰质炎病毒 |
6周 |
4周 |
如果当前年龄为 <4 岁 |
6 个月 |
|
|
麻疹、流行性腮腺炎、风疹 |
12个月 |
4周 |
| | |
|
水痘 |
12个月 |
3个月 |
| | |
|
甲型肝炎 |
12个月 |
6个月 |
| | |
|
脑膜炎球菌 ACWY |
2个月MenACWY-CRM 2 年 MenACWY-TT |
8周 |
查看注释 |
查看注释 |
|
7 至 18 岁的儿童和青少年
|
疫苗 |
第 1 剂的最低年龄 |
剂量之间的最小间隔 |
||
|---|---|---|---|---|
|
第 1 剂至第 2 剂 |
第 2 剂至第 3 剂 |
第 3 剂至第 4 剂 |
||
|
脑膜炎球菌 ACWY |
不适用 (N/A) |
8周 |
| |
|
破伤风,白喉;破伤风、白喉和无细胞百日咳 |
7年 |
4周 |
如果在 1 之前给药第一剂 DTaP/DT,则为4 周 |
如果在 1 之前施用第一剂 DTaP/DT,则为6 个月 |
|
人乳头瘤病毒 |
9年 |
建议常规给药间隔。 |
||
|
甲型肝炎 |
不适用 |
6个月 |
| |
|
乙型肝炎 |
不适用 |
4周 |
首次给药后 8 周和至少 16 周。 |
|
|
灭活脊髓灰质炎病毒 |
不适用 |
4周 |
6 个月 |
如果所有先前的剂量都是在 <4 岁时接种的,或者如果第三剂是在第二剂后<6 个月接种的,则需要接种第四剂 IPV。 |
|
麻疹、流行性腮腺炎、风疹 |
不适用 |
4周 |
| |
|
水痘 |
不适用 |
如果小于 13 岁,则为3 个月。 |
| |
|
登革热 |
9年 |
6个月 |
6个月 |
|
按医学适应症划分的儿童和青少年免疫接种计划
说明

- 有关HIV实验室参数和活疫苗使用的更多信息,请参阅免疫接种的一般最佳实践指南
- 严重联合免疫缺陷
- LAIV4 禁用于 2-4 岁在过去 12 个月内患有哮喘或喘息的儿童
儿童免疫接种时间表说明
如果免疫接种史不完整或未知,应接种推荐的疫苗。不要重新开始或增加疫苗系列的剂量,以延长剂量之间的间隔。如果疫苗未在推荐年龄接种,则在随后的就诊时接种。
- 为了计算剂量之间的间隔,4 周 = 28 天。≥4 个月的间隔由日历月决定。
- 在数字范围内(例如,12-18),短划线 (–) 应读作“通过”。
- 在最低年龄或间隔前≤4 天接种的疫苗剂量被视为有效。比最低年龄或最短间隔早≥5天接种的任何疫苗剂量不应被视为有效,应根据年龄重复接种。重复剂量应在无效剂量之后间隔建议的最小间隔。
COVID-19 疫苗接种
(最低年龄:6 个月 [Moderna 和 Pfizer-BioNTech COVID-19 疫苗],12 岁 [Novavax COVID-19 疫苗])
常规疫苗接种
年龄 6 个月至 4 岁
- 未接种疫苗:
- 0、4-8 周时更新(2023-2024 年配方)Moderna 的 2 剂系列
- 0、3-8、11-16 周的 3 剂更新(2023-2024 配方)辉瑞-BioNTech 系列
- 之前接种过1剂任何Moderna疫苗*:最近一剂后 4-8 周接种 1 剂更新的(2023-2024 年配方)Moderna。
- 之前接种过2剂或更多剂任何Moderna疫苗*:在最近一剂后至少 8 周接种 1 剂更新的(2023-2024 年配方)Moderna。
- 之前接种过1剂任何辉瑞-BioNTech疫苗*:在 0、8 周时接种 2 剂更新(2023-2024 年配方)辉瑞-BioNTech 系列(之前的辉瑞-BioNTech 和第 1 剂之间的最短间隔:3-8 周)。
- 之前接种过 2 剂或更多剂任何辉瑞-BioNTech疫苗*:在最近一剂后至少 8 周接种 1 剂更新(2023-2024 年配方)辉瑞-BioNTech。
5-11岁
- 未接种疫苗:1 剂更新(2023-2024 年配方)Moderna 或 Pfizer-BioNTech 疫苗。
- 之前接种过1剂或多剂Moderna或Pfizer-BioNTech疫苗*:在最近一剂后至少 8 周接种 1 剂更新(2023-2024 年配方)Moderna 或 Pfizer-BioNTech。
12-18岁
- 未接种疫苗:
- 1 剂更新(2023-2024 年配方)Moderna 或辉瑞-BioNTech 疫苗
- 2剂更新(2023-2024 年配方)诺瓦瓦克斯系列在 0、3-8 周时
- 之前接种过任何 COVID-19 疫苗*:在最近一剂后至少 8 周接种 1 剂任何更新的(2023-2024 年配方)COVID-19 疫苗。
*注意:先前接种疫苗的定义是在更新的 2023-2024 年配方之前接种过任何原始单价或二价 COVID-19 疫苗(杨森、莫德纳、诺瓦瓦克斯、辉瑞-BioNTech)。
当有不止一种推荐的适龄疫苗可用时,没有优先推荐使用一种COVID-19疫苗而不是另一种疫苗。
为每剂疫苗接种适合年龄的COVID-19疫苗产品。
特殊情况
中度或重度免疫功能低下者**
年龄 6 个月至 4 岁
- 未接种疫苗:
- 0、4、8 周时更新(2023-2024 年配方)Moderna 的 3 剂系列
- 0、3、11 周时更新(2023-2024 年配方)辉瑞-BioNTech 的 3 剂系列。
- 之前接种过 1 剂任何 Moderna:2 剂更新(2023-2024 年配方)Moderna 系列,接种 0、4 周(之前的 Moderna 和第 1 剂之间的最短间隔:4 周)。
- 之前接种过 2 剂任何 Moderna 疫苗*:在最近一剂后至少 4 周接种 1 剂更新的(2023-2024 年配方)Moderna。
- 之前接种过3剂或更多剂任何Moderna疫苗*:在最近一剂后至少 8 周接种 1 剂更新的(2023-2024 年配方)Moderna。
- 之前接种过1剂任何辉瑞-BioNTech疫苗*:在 0、8 周时接种 2 剂更新(2023-2024 年配方)辉瑞-BioNTech 系列疫苗(之前的辉瑞-BioNTech 和第 1 剂之间的最短间隔:3 周)。
- 之前接种过 2 剂或更多剂任何辉瑞-BioNTech疫苗*:在最近一剂后至少 8 周接种 1 剂更新(2023-2024 年配方)辉瑞-BioNTech。
5-11岁
- 未接种疫苗:
- 0、4、8 周时更新(2023-2024 年配方)Moderna 的 3 剂系列
- 3 剂系列更新(2023-2024 配方)辉瑞-BioNTech 在 0、3、7 周。
- 之前接种过 1 剂任何 Moderna:2 剂更新(2023-2024 年配方)Moderna 系列,接种 0、4 周(之前的 Moderna 和第 1 剂之间的最短间隔:4 周)。
- 之前接种过2剂任何Moderna疫苗*:在最近一剂后至少 4 周接种 1 剂更新的(2023-2024 年配方)Moderna。
- 之前接种过1剂任何辉瑞-BioNTech疫苗*:2 剂更新(2023-2024 年配方)辉瑞-BioNTech 系列在 0、4 周时接种(之前的辉瑞-BioNTech 和第 1 剂之间的最短间隔:3 周)
- 之前接种过2剂任何辉瑞-BioNTech疫苗*:在最近一剂疫苗后至少 4 周接种 1 剂 2023-2024 辉瑞-BioNTech。
- 之前接种过3剂或更多剂任何 Moderna或Pfizer-BioNTech疫苗*:在最近一剂后至少 8 周接种 1 剂更新(2023-2024 年配方)Moderna 或 Pfizer-BioNTech。
12-18岁
- 未接种疫苗:
- 0、4、8 周时更新(2023-2024 年配方)Moderna 的 3 剂系列
- 0、3、7 周时更新(2023-2024 年配方)辉瑞-BioNTech 的 3 剂系列
- 2剂系列更新(2023-2024 年配方)Novavax 在 0、3 周时
- 之前接种过 1 剂任何 Moderna*:2 剂更新(2023-2024 年配方)Moderna 系列,接种 0、4 周(之前的 Moderna 剂量和剂量 1 之间的最短间隔:4 周)。
- 之前接种过 2 剂任何 Moderna 疫苗*:在最近一剂后至少 4 周接种 1 剂更新的(2023-2024 年配方)Moderna。
- 之前接种过1剂任何辉瑞-BioNTech疫苗*:在 0、4 周时接种 2 剂更新(2023-2024 年配方)辉瑞-BioNTech 系列疫苗(之前的辉瑞-BioNTech 剂量和第 1 剂之间的最小间隔:3 周)。
- 之前接种过2剂任何辉瑞-BioNTech疫苗*:在最近一剂后至少 4 周接种 1 剂更新(2023-2024 年配方)辉瑞-BioNTech。
- 之前接种过3剂或更多剂任何 Moderna或Pfizer-BioNTech疫苗*:在最近一剂后至少 8 周接种 1 剂任何更新的(2023-2024 年配方)COVID-19 疫苗。
- 之前接种过 1 剂或多剂杨森或诺瓦瓦克斯疫苗*,或接种或不接种任何原始单价或二价 COVID-19 疫苗:在最近一剂后至少 8 周接种 1 剂任何更新的(2023-2024 年配方)COVID-19 疫苗。
当有不止一种推荐的适龄疫苗可用时,没有优先推荐使用一种COVID-19疫苗而不是另一种疫苗。
*注意:先前接种疫苗的定义是在更新的 2023-2024 年配方之前接种过任何原始单价或二价 COVID-19 疫苗(杨森、莫德纳、诺瓦瓦克斯、辉瑞-BioNTech)。
**注意:中度或重度免疫功能低下的人可以选择在最后一次推荐的更新(2023-2024 年配方)COVID-19 疫苗剂量后至少 2 个月再接种一剂更新的(2023-2024 年配方)COVID-19 疫苗。根据医疗保健提供者的临床判断以及个人偏好和情况,可以进一步额外更新(2023-2024 年公式)接种 COVID-19 疫苗剂量。任何进一步的额外剂量应在上次更新(2023-2024 年公式)COVID-19 疫苗剂量后至少 2 个月接种。6 个月至 4 岁的中度或重度免疫功能低下儿童如果接种额外剂量,应接种同源更新(2023-2024 年配方)mRNA 疫苗剂量。
登革热疫苗接种
(最低年龄:9岁)
常规疫苗接种
- 年龄 9-16 岁居住在登革热流行地区,并且有实验室确认以前感染过登革热
- 在 0、6 和 12 个月时进行 3 剂系列接种
- 流行地区包括波多黎各、美属萨摩亚、美属维尔京群岛、密克罗尼西亚联邦、马绍尔群岛共和国和帕劳共和国。
- 登革热疫苗不应用于前往登革热流行地区或访问登革热流行地区的儿童。
白喉、破伤风和百日咳 (DTaP) 疫苗接种
(最低年龄:6 周 [Kinrix® 或 Quadracel® 为 4 岁])
常规疫苗接种
- 5 剂系列(2、4 和 6 个月大时接种 3 剂初级系列,然后在 15-18 个月和 4-6 岁时接种加强剂
- 前瞻 性:如果自第 3 剂以来至少过去了 6 个月,则最早可在 12 个月大时接种第 4 剂。
- 回顾:如果自第 3 剂以来至少过去了 4 个月,则早在 12 个月大时无意中接种的第 4 剂可以计算在内。
补种疫苗
- 如果第 4 剂是在 4 岁或以上且第 3 剂后至少 6 个月给药的,则不需要第 5 剂。
特殊情况
- 未满 7 岁且有 3 剂或更多剂含破伤风类毒素疫苗史的儿童的伤口处理:对于除清洁伤口和轻微伤口外的所有伤口,如果自上次接种含破伤风类毒素疫苗以来超过 5 年,则给予 DTaP。
乙型流感嗜血杆菌疫苗接种
(最低年龄:6周)
常规疫苗接种
- ActHIB、Hiberix、Pentacel 或 Vaxelis:®®®®4 剂系列(2、4 和 6 个月大时接种 3 剂初级系列,然后在 12-15 个月大时接种加强剂*)
- *不建议将 Vaxelis 用作加强剂量。加强剂量应使用另一种含 Hib 的疫苗。®
- PedvaxHIB:®3 剂系列(2 个月和 4 个月大时接种 2 剂初级系列,然后在 12-15 个月大时接种加强剂)
补种疫苗
- 第 1 剂在7-11 月龄时接种:至少 4 周后接种第 2 剂,在第 2 剂后 12-15 个月或第 8 周(以较晚者为准)接种第 3 剂(最终剂量)。
- 12-14 个月龄时接种第 1 剂:第 1 剂后至少 8 周接种第 2 剂(最后一剂)。
- 12 个月龄前接种 1 剂,15 月龄前接种 2 剂:在第 2 剂后至少 8 周给予第 3 剂(最终剂量)。
- 12 个月大前接种 2 剂 PedvaxHIB:®在 12-59 个月大时和第 2 剂后至少 8 周接种第 3 剂(最后一剂)。
- 在 15 个月或以上时接种 1 剂:无需进一步给药
- 15-59 个月大时未接种疫苗:服用 1 剂。
- 以前未接种疫苗的 60 个月或以上且不被视为高风险的儿童:不需要补种疫苗
特殊情况
- 化疗或放疗:
年龄 12-59 个月
- 未接种疫苗或仅在 12 个月龄前接种 1 剂:2 剂,间隔 8 周
- 12 个月龄前接种 2 剂或更多剂:上一次接种后至少 8 周接种 1 剂
在开始治疗后14天内或治疗期间给药的剂量应在治疗完成后至少3个月重复。
- 造血干细胞移植(HSCT):
- 无论 Hib 疫苗接种史如何,在成功移植后 6 至 12 个月开始间隔 4 周的 3 剂系列
- 解剖性或功能性无脾(包括镰状细胞病):
年龄 12-59 个月
- 未接种疫苗或仅在 12 个月龄前接种 1 剂:2 剂,间隔 8 周
- 12 个月龄前接种 2 剂或更多剂:上一次接种后至少 8 周接种 1 剂
未接种疫苗*的 5 岁或以上人士
- 1剂
- 择期脾切除术:
未接种疫苗*的 15 个月或以上人士
- 1 剂(最好在手术前至少 14 天)
- HIV感染:
年龄 12-59 个月
- 未接种疫苗或仅在 12 个月龄前接种 1 剂:2 剂,间隔 8 周
- 12 个月龄前接种 2 剂或更多剂:上一次接种后至少 8 周接种 1 剂
未接种疫苗*的 5-18 岁人士
- 1剂
- 免疫球蛋白缺乏症、早期成分补体缺乏症:
年龄 12-59 个月
- 未接种疫苗或仅在 12 个月龄前接种 1 剂:2 剂,间隔 8 周
- 12 个月龄前接种 2 剂或更多剂:上一次接种后至少 8 周接种 1 剂
*未接种疫苗= 少于常规系列(至 14 个月大)或未接种(15 个月或以上)
接种甲型肝炎疫苗
(最低年龄:常规接种12个月)
常规疫苗接种
- 12-23 个月大时接种 2 剂系列疫苗(最短间隔:6 个月)
补种疫苗
- 18 岁以下未接种疫苗的人应完成 2 剂系列接种(最短间隔:6 个月)。
- 之前在 12 个月或以上接种过 1 剂疫苗的人应在第 1 剂后至少 6 个月接种第 2 剂。
- 18 岁或以上的青少年可以接种 HepA 和 HepB 联合疫苗,双峰®,作为 3 剂系列(0、1 和 6 个月)或 4 剂系列(0、7 和 21-30 天 3 剂,然后在 12 个月时加强剂量)。
国际旅行
- 前往甲型肝炎或中度地方性肝
炎国家旅行或工作的人)- 6-11个月的婴儿:出发前接种1剂;在 12-23 个月大之间用 2 剂(间隔至少 6 个月)重新接种。
- 未接种疫苗的 12 个月或以上:一旦考虑旅行,请立即接种第 1 剂。
乙型肝炎疫苗接种
(最低年龄:出生)
常规疫苗接种
- 0、1-2、6-18 月龄时接种 3 剂系列疫苗(6 周龄前接种剂量为单价 HepB 疫苗)
- 出生体重≥2,000 克:如果身体状况稳定,出生后 24 小时内服用 1 剂
- 出生体重<2,000 克:在实际年龄 1 个月或出院时服用 1 剂(以较早者为准,即使体重仍为 <2,000 克)。
- 未接受出生剂量的婴儿应尽快开始该系列治疗。
- 当在出生剂量后使用含有 HepB 的联合疫苗时,允许接种 4 剂。
- 最小间隔:当施用4剂时,在这些计算中用“剂量4”代替“剂量3”
- 最终(第 3 剂或第 4 剂):6-18 个月大(最低年龄 24 周)
- 母亲是HBsAg阳性
- 出生剂量(仅限单价 HepB 疫苗):无论出生体重如何,在
出生后 12 小时内接种HepB 疫苗和乙型肝炎免疫球蛋白 (HBIG)(在单独的肢体中)。 - 出生体重<2000克:从1个月大开始再接种3剂乙肝疫苗(共4剂)
- 最终(第 3 剂或第 4 剂):在 6 个月大时给药(最低年龄 24 周)
- 在 9-12 个月大时检测 HBsAg 和抗 HB。如果 HepB 系列治疗延迟,则在最终给药后 1-2 个月进行检测。不要在 9 个月大之前进行测试。
- 出生剂量(仅限单价 HepB 疫苗):无论出生体重如何,在
- 母亲是HBsAg-未知
如果存在其他提示母体乙型肝炎感染的证据(例如,存在 HBV DNA、HBeAg 阳性或已知母亲患有慢性乙型肝炎感染),则将婴儿视为母亲 HBsAg 阳性
- 出生剂量(仅限单价乙肝疫苗):
- 出生体重≥2,000 克:在出生后 12 小时内接种乙肝疫苗。尽快确定母亲的 HBsAg 状态。如果确定母亲是HBsAg阳性,应尽快给予HBIG(在单独的肢体中),但不迟于7天大。
- 出生体重<2,000 克:在出生后 12 小时内接种HepB 疫苗和HBIG(在单独的肢体中)。从 1 个月大开始再接种 3 剂乙肝疫苗(共 4 剂)
- 最终(第 3 剂或第 4 剂):在 6 个月大时给药(最低年龄 24 周)
- 如果确定母亲为 HBsAg 阳性或状态仍然未知,则在 9-12 个月大时检测 HBsAg 和抗 HB。如果 HepB 系列治疗延迟,则在最终给药后 1-2 个月进行检测。不要在 9 个月大之前进行测试。
- 出生剂量(仅限单价乙肝疫苗):
补种疫苗
- 未接种疫苗的人应在 0、1-2、6 个月时完成 3 剂系列接种。有关最小间隔,请参见表 2
- 11-15 岁的青少年可以使用替代的 2 剂方案,两次给药之间至少间隔 4 个月(成人制剂Recombivax HB系列®仅)。
- 18 岁的青少年可能会获得:
- Heplisav-B:2 剂系列,至少间隔 4 周®
- PreHevbrio:0、1 和 6 个月时的 3 剂系列®
- HepA 和 HepB 联合疫苗,Twinrix:3 剂系列(0、1 和 6 个月)或 4 剂系列(0、7 和 21-30 天 3 剂,然后在 12 个月时加强剂量)。®
特殊情况
- 对于在婴儿、儿童、青少年或成人时期接种过疫苗的免疫状态正常的人,通常不建议重新接种疫苗。
- 对于某些人群,建议进行疫苗接种后血清学检测和再接种(如果抗 HBs<10mlU/mL),包括:
- HBsAg阳性母亲所生的婴儿
- 透析前或维持性透析者
- 其他免疫功能低下的人
注意:由于缺乏孕妇的安全数据,不建议在怀孕期间使用 Heplisav-B 和 PreHevbrio。
人瘤病毒疫苗接种
(最低年龄:9岁)
常规和补种疫苗接种
- 常规建议在11-12 岁时接种 HPV 疫苗(可在 9 岁时开始接种),如果未充分接种疫苗,建议所有 18 岁以下的人接种补种 HPV 疫苗
- 2 剂或 3 剂系列,具体取决于初次接种疫苗的年龄:
- 初次接种疫苗时年龄 9 -14 岁:0、6-12 个月时接种 2 剂系列疫苗(最短间隔:5 个月;如果过早给药,则重复给药)
- 初次接种疫苗时年满 15 岁:0、1-2 个月、6 个月时接种 3 剂系列(最短间隔:第 1 剂至第 2 剂:4 周/第 2 剂至第 3 剂:12 周/第 1 剂至第 3 剂:5 个月;如果过早给药,则重复给药)
- 当使用推荐的给药间隔完成任何价位的任何 HPV 疫苗系列时,不建议额外剂量。
特殊情况
- 免疫功能低下的情况,包括 HIV 感染:3 剂系列接种,即使是在 9 至 14 岁时开始接种疫苗的人。
- 性虐待或性侵犯史:从 9 岁开始。
- 怀孕:接种疫苗前不需要妊娠试验;不建议在怀孕后接种HPV疫苗;如果在怀孕期间接种疫苗,则无需干预
接种流感疫苗
(最低年龄:6个月[IIV]、2岁[LAIV4]、18岁[重组流感疫苗,RIV4])
常规疫苗接种
- 每年使用任何适合年龄和健康状况的流感疫苗:
- 年龄在6个月至 8岁之间,在 2023 年 7 月 1日之前接种少于2 剂流感疫苗,或流感疫苗接种史不明:接种 2 剂,间隔至少 4 周。即使孩子在接受第 1 剂和第 2 剂之间年满 9 岁,也应接种第 2 剂。
- 6 个月至 8 岁且在 2023 年 7 月 1 日之前接种过至少2 剂流感疫苗:1 剂
- 9岁或以上:1剂
- 对于 2024-25 赛季,请参阅 2024-25 ACIP 流感疫苗建议。
注意:对鸡蛋过敏的人可以接种任何适合年龄和健康状况的流感疫苗(以鸡蛋为基础和非以鸡蛋为基础)。
特殊情况
- 需要受保护环境的严重免疫抑制者的密切接触者(例如家庭接触者):不应接受 如果给予LAIV4,则应在接种疫苗后7天内避免与此类免疫抑制者接触。
注意:对鸡蛋过敏的人可以接种任何适合年龄和健康状况的流感疫苗(以鸡蛋为基础和非以鸡蛋为基础)。
麻疹、流行性腮腺炎和风疹疫苗接种
(最低年龄:常规疫苗接种 12 个月)
常规疫苗接种
- 12-15 个月龄、4-6 岁时接种 2 剂系列疫苗
- MMR 或 MMRV 可施用*
注意:对于 12-47 个月儿童的第 1 剂,建议分别接种 MMR 和水痘疫苗。如果父母或看护人表示偏好,可以使用 MMRV。*
*注意:如果使用 MMRV,MMRV 剂量之间的最短间隔为 3 个月
补种疫苗
- 未接种疫苗的儿童和青少年:至少间隔 4 周的 2 剂系列*
- 使用 MMRV 的最高年龄为 12 岁。*
*注意:如果使用 MMRV,MMRV 剂量之间的最短间隔为 3 个月
特殊情况
- 国际旅行
- 6-11个月的婴儿:出发前接种1剂;在 12-15 月龄时(高危地区儿童为 12 个月)进行 2 剂系列接种,并在 4 周后最早接种 2 剂。*
- 12 个月或以上未接种疫苗的儿童:出发前至少间隔 4 周接种 2 剂系列疫苗*
*注意:如果使用 MMRV,MMRV 剂量之间的最短间隔为 3 个月
脑膜炎球菌血清群 A、C、W、Y 疫苗接种
(最低年龄:2 个月 [MenACWY-CRM、Menveo]、2 岁 [MenACWY-TT、MenQuadfi])、10 年 [MenACWY-TT/MenB-FHbp、Penbraya])
常规疫苗接种
- 11-12 岁时接种 2 剂系列疫苗;16 岁
补种疫苗
- 13-15 岁:现在接种 1 剂,16-18 岁接种加强针(最短间隔:8 周)
- 16-18岁:1剂
特殊情况
解剖学或功能性无脾(包括镰状细胞病)、HIV 感染、持续补体成分缺乏、补体抑制剂(例如依库珠单抗、ravulizumab)使用:
- 门维奥®*
- 2 月龄时接种 1 剂:4 剂系列接种(4 个月、6 个月和 12 月龄时额外接种 3 剂)
- 3-6 月龄时接种第 1 剂:3 剂或 4 剂系列(第 2 剂 [和第 3 剂,如果适用]在上一剂后至少 8 周接种,直到 7 个月或以上时接种一剂,然后在至少 12 周后和 12 个月龄后再接种一剂)
- 7-23 月龄时接种第 1 剂:2 剂系列接种(第 1 剂后至少 12 周和 12 月龄后接种第 2 剂)
- 在 24 个月或以上时接种 1 剂:2 剂系列接种,间隔至少 8 周
- 门奎德菲®
- 在 24 个月或以上时接种 1 剂:2 剂系列接种,间隔至少 8 周
前往高流行性或流行性脑膜炎球菌病国家,包括非洲脑膜炎带或朝觐
期间的国家:
- 24 个月以下的儿童:
- Menveo(2-23 个月大)®*
- 2 月龄时接种 1 剂:4 剂系列接种(4 个月、6 个月和 12 月龄时额外接种 3 剂)
- 3-6 月龄时接种第 1 剂:3 剂或 4 剂系列(第 2 剂 [和第 3 剂,如果适用]在上一剂后至少 8 周接种,直到 7 个月或以上时接种一剂,然后在至少 12 周后和 12 个月龄后再接种一剂)
- 7-23 月龄时接种第 1 剂:2 剂系列接种(第 1 剂后至少 12 周和 12 月龄后接种第 2 剂)
- Menveo(2-23 个月大)®*
- 2 岁或以上儿童:1 剂 Menveoor MenQuadfi®*®
住在住宅的一年级大学生(如果之前在 16 岁或以上之前没有接种疫苗)或新兵:
- 1 剂Menveo或MenQuadfi®*®
在 10 岁之前接受 MenACWY 的儿童的青少年疫苗接种:
- 因脑膜炎球菌病风险持续增加而建议接种加强针的儿童(例如补体成分缺乏症、HIV 或无脾病的儿童):对于高危人群,请遵循加强针接种计划。
- 不建议接种加强针的儿童(例如,因前往脑膜炎球菌病流行国家/地区旅行而接受单剂治疗的健康儿童):根据推荐的青少年方案给予 MenACWY,在 11-12 岁时接种第 1 剂,在 16 岁时接种第 2 剂。
* Menveo 有两种配方:冻干和液体。液体制剂不应在 10 岁之前使用。
10 岁或以上的儿童可以接受单剂 Penbraya™ 作为单独接种 MenACWY 和 MenB 的替代方法,前提是两种疫苗将在同一门诊日接种(更多信息参见下文 “脑膜炎球菌血清群 B 疫苗接种”部分)。
脑膜炎球菌血清群 B 疫苗接种
(最低年龄:10 岁 [MenB-4C,Bexsero;MenB-FHbp,杜门巴;MenACWY-TT/MenB-FHbp,彭布拉亚®®™])
共享临床决策
- 16-23 岁(首选年龄 16-18 岁)非高危青少年,基于共同临床决策:
- 贝克塞罗:®2 剂系列,间隔至少 1 个月
- 杜门巴:®间隔至少 6 个月的 2 剂系列(如果第 2 剂早于 6 个月给药,则给予 3 剂RD路剂量 2 后至少 4 个月)
特殊情况
解剖学或功能性无脾(包括镰状细胞病)、持续性补体成分缺乏、补体抑制剂(例如依库珠单抗、ravulizumab)使用:
- 贝克塞罗:®2 剂系列,间隔至少 1 个月
- 杜门巴:®0、1-2、6 个月的 3 剂系列(如果第 2 剂在第 1 剂后至少 6 个月给药,则不需要第 3 剂;如果第 3 剂早于第 2 剂后 4 个月给药,则为 4第剂量应在第 3 剂后至少 4 个月给药)
注意:Bexsero®和杜门巴®不可互换;一个系列中的所有剂量都应使用相同的产品。
10 岁或以上的儿童可以接种一剂 Penbraya™ 作为单独接种 MenACWY 和 MenB 的替代方法,前提是这两种疫苗将在同一门诊日接种。对于没有增加风险的适龄儿童,如果 Penbraya™用于第 1 剂 MenB,MenB-FHbp (Trumenba) 应用于第 2 剂 MenB。对于脑膜炎球菌病风险增加的适龄儿童,Penbraya™可用于额外的 MenACWY 和 MenB 剂量(包括加强剂量),如果两者将在同一门诊日给药,并且自最近一次 Penbraya 以来至少已经过去了 6 个月™剂量。
接种猴痘疫苗
(最低年龄:18岁[Jynneos®])
特殊情况
- 年龄 18 岁且有猴痘感染风险:接种 2 剂系列疫苗,间隔 28 天。
- 猴痘感染的危险因素包括:
- 男同性恋、双性恋和其他男男性行为者、跨性别者或非二元性别者在过去 6 个月内有:
- 至少 1 种性传播疾病的新诊断
- 超过1个性伴侣
- 在商业性场所发生性行为
- 在发生猴痘传播的地理区域内与大型公共活动相关的性行为
- 与上述人员有性伴侣的人
- 预计会遇到上述任何情况的人
- 男同性恋、双性恋和其他男男性行为者、跨性别者或非二元性别者在过去 6 个月内有:
- 猴痘感染的危险因素包括:
- 怀孕:由于缺乏怀孕期间的安全性数据,目前没有ACIP建议在怀孕期间使用Jynneos。具有上述任何危险因素的孕妇可以接受 Jynneos。
肺炎球菌疫苗接种
(最低年龄:6周[PCV15]、[PCV 20];2岁[PPSV23])
常规接种PCV
- 2、4、6、12-15 个月的 4 剂系列
PCV补种
- 2-4 岁健康儿童,患有任何不完整*
PCV 系列:1 剂 PCV
注意:当有 PCV 指征时,可以使用 PCV15 或 PCV20。对于没有风险条件的儿童,如果他们已经接种了 4 剂 PCV13 或 PCV15 或其他适合年龄的完整 PCV 系列,则不建议接种 PCV20。
特殊情况
脑脊液渗漏的儿童和青少年;慢性心脏病;慢性肾病(不包括维持性透析和肾病综合征);慢性肝病;慢性肺病(包括中度持续性或重度持续性哮喘);人工耳蜗;或糖尿病:
2-5岁
- 任何不完整* PCV 系列:
- 3 剂 PCV:1 剂 PCV(最近一次 PCV 剂量后至少 8 周)
- 少于 3 剂 PCV:2 剂 PCV(最近一次给药后至少 8 周,间隔至少 8 周给药)
- 已完成推荐的PCV系列,但尚未收到PPSV23
- 之前接受过至少 1 剂 PCV20:不需要进一步的 PCV 或 PPSV23 剂量
- 以前未接种过 PCV20:在最近一次 PCV 剂量后至少 8 周接种 1 剂 PCV20 或 1 剂 PPSV23。
6-18岁
- 以前未接受过任何剂量的 PCV13、PCV15 或 PCV20:接种 1 剂 PCV15 或 PCV20。如果使用 PCV15 并且之前没有接受过 PPSV23,请在 PCV15 剂量后至少 8 周接种 1 剂 PPSV23。
- 在 6 岁之前接受过 PCV,但尚未接受过 PPSV23
- 之前接受过至少 1 剂 PCV20:不需要进一步的 PCV 或 PPSV23 剂量
- 以前未接种过 PCV20:在最近一次 PCV 剂量后至少 8 周接种 1 剂 PCV20 或 1 剂 PPSV23。如果使用 PPSV23,则在 1 PPSV23 剂量后至少 5 年给予 PCV20 或第 2 剂 PPSV23。
- 仅在 6 岁时或之后接受 PCV13:在最近一次 PCV13 剂量后至少 8 周接种 1 剂 PCV20 或 1 剂 PPSV23。
- 在 6 岁或之后接受 1 剂 PCV13 和 1 剂 PPSV23:没有指示进一步剂量的任何 PCV 或 PPSV23。
接受维持性透析的儿童和青少年,或患有免疫功能低下疾病(如肾病综合征)的儿童和青少年;先天性或后天性无脾或脾功能障碍;先天性或后天性免疫缺陷;接受免疫抑制药物或放射治疗的疾病和病症,包括恶性肿瘤、白血病、淋巴瘤、霍奇金病和实体器官移植;HIV感染;或镰状细胞病或其他血红蛋白病:
2-5岁
- 任何不完整* PCV 系列:
- 3 剂 PCV:1 剂 PCV(最近一次 PCV 剂量后至少 8 周)
- 少于 3 剂 PCV:2 剂 PCV(最近一次给药后至少 8 周,间隔至少 8 周给药)
- 已完成推荐的PCV系列,但尚未收到PPSV23
- 之前接受过至少 1 剂 PCV20:不需要进一步的 PCV 或 PPSV23 剂量
- 以前未接种过 PCV20:在最近一次 PCV 后至少 8 周接种 1 剂 PCV20 或 1 剂 PPSV23。如果使用 PPSV23,则在第 1 剂 PPSV23 后至少 5 年接种 1 剂 PCV20 或第 2 剂 PPSV23。
6-18岁
- 以前未接种过任何剂量的 PCV13、PCV15 或 PCV20:接种 1 剂 PCV15 或 1 剂 PCV20。如果使用 PCV15 并且之前没有接受过 PPSV23,请在 PCV15 剂量后至少 8 周接种 1 剂 PPSV23。
- 在 6 岁之前接受过 PCV,但尚未接受过 PPSV23
- 之前接受过至少 1 剂 PCV20:没有额外剂量的 PCV 或 PPSV23
- 以前未接种过 PCV20:在最近一次 PCV 剂量后至少 8 周接种 1 剂 PCV20 或 1 剂 PPSV23。如果使用 PPSV23,则在 1 PPSV23 剂量后至少 5 年给予 PCV20 或第 2 剂 PPSV23。
- 仅在 6 岁时或之后接受 PCV13:在最近一次 PCV13 剂量后至少 8 周接种 1 剂 PCV20 或 1 剂 PPSV23。如果使用 PPSV23,则在第 1 剂 PPSV23 后至少 5 年接种 1 剂 PCV20 或第 2 剂 PPSV23。
- 在 6 岁或之后接受 1 剂 PCV13 和 1 剂 PPSV23:在最近一次 PCV13 剂量后至少 8 周和第 1 剂 PPSV23 后至少 5 年接种 1 剂 PCV20 或 1 剂 PPSV23。
*不完整系列= 未接受推荐系列或适合年龄的补种系列中的所有剂量。
**当同时出现 PCV15 和 PPSV23 时,首先给予所有剂量的 PCV15。PCV15 和 PPSV23 不应在同一次就诊期间给药。
脊髓灰质炎病毒疫苗接种
(最低年龄:6周)
常规疫苗接种
- 2、4、6-18 个月、4-6 岁时的 4 剂系列;在 4 岁或之后以及上一次给药后至少 6 个月接种最后一剂。
- 当使用含有灭活脊灰病毒的复方疫苗时,可以在 4 岁之前接种 4 剂或更多剂灭活脊灰病毒。但是,仍建议在 4 岁或之后以及上一次给药后至少 6 个月接种一剂。
补种疫苗
- 在出生后的前 6 个月内,仅对前往脊髓灰质炎流行地区或疫情暴发期间使用最小年龄和间隔。
- 已知或疑似未接种疫苗或未完全接种疫苗的 18 岁青少年:接种剩余剂量(1、2 或 3 剂 IPV)以完成 3 剂初级系列。 除非有具体理由相信他们没有接种疫苗,否则大多数在美国出生和长大的 18 岁或以上的人可以认为他们小时候接种过脊髓灰质炎疫苗。
含有口服脊髓灰质炎病毒疫苗(OPV)的系列疫苗,混合型口服脊髓灰质炎病毒-灭活脊髓灰质炎疫苗或纯口服脊髓灰质炎疫苗系列:
- 完成该系列所需的总剂量与美国 IPV 计划推荐的剂量相同。
- 只有三价口服脊髓灰质炎疫苗(tOPV)才计入美国的疫苗接种要求。
- 2016 年 4 月 1 日之前接种的 OPV 剂量应计算在内(除非特别注明在活动期间接种)。
- 2016年4月1日或之后接种的口服脊髓灰质炎疫苗剂量不应计算在内。
特殊情况
- 18 岁暴露于脊髓灰质炎病毒风险增加且已完成初级系列接种*的青少年:可终生接种一次 IPV 加强针
*注意:完整的初级系列包括至少 3 剂 IPV 或三价口服脊髓灰质炎病毒疫苗 (tOPV) 的任意组合。
呼吸道合胞病毒免疫
(最低年龄:出生 [Nirsevimab、RSV-mAb (Beyfortus™)
常规疫苗接种
- 10 月至 3 月在美国大陆大部分地区出生的婴儿*
- 母亲未接种 RSV 疫苗或母亲的 RSV 疫苗接种状态未知:出生后 1 周内在医院或门诊接种 1 剂 nirsevimab
- 母亲在分娩前不到 14 天接种了 RSV 疫苗:出生后 1 周内在医院或门诊接种 1 剂 nirsevimab
- 母亲在分娩前至少14天接种了 RSV疫苗:不需要 nirsevimab,但在极少数情况下可由医疗保健提供者自行决定
- 4 月至 9 月在美国大陆大部分地区出生的婴儿*
- 母亲未接种 RSV 疫苗或母亲的 RSV 疫苗接种状态未知:在 RSV 季节开始前不久接种 1 剂 nirsevimab*
- 母亲在分娩前不到14天接种了 RSV 疫苗:在 RSV 季节开始前不久接种 1 剂 nirsevimab*
- 母亲在分娩前至少14天接种了 RSV疫苗:不需要 nirsevimab,但在极少数情况下可由医疗保健提供者自行决定
- 10 月至 3 月出院的分娩住院时间延长**(例如早产儿)的婴儿应在出院前不久或出院后立即进行免疫接种。
特殊情况
- 年龄在8-19个月之间患有慢性早产儿肺病,需要医疗支持(例如,慢性皮质类固醇治疗、利尿剂治疗或辅助供氧)在第二个 RSV 季节开始前的 6 个月内的任何时间; 严重的免疫功能低下; 囊性纤维化伴长度别体重<第 10 个百分位数或表现严重肺部疾病(例如,既往在出生后第一年因肺部加重住院,或胸部影像学异常在稳定时持续存在)**:
- 在第二个 RSV 季节开始前不久服用 1 剂 nirsevimab*
- 8-19 个月大的美洲印第安人或阿拉斯加原住民:
- 在第二个 RSV 季节开始前不久服用 1 剂 nirsevimab*
- 符合年龄条件并正在接受心脏手术和体外循环**:手术后额外服用 1 剂 nirsevimab。
*注意:虽然 RSV 季节的发病时间和持续时间可能有所不同,但在美国大陆的大部分地区,nirsevimab 可能在 10 月至 3 月给药。RSV 季节性与美国大陆大部分地区不同的司法管辖区(例如,阿拉斯加、热带气候司法管辖区)的提供者应遵循公共卫生当局(例如 CDC、卫生部门)或区域医疗中心关于基于当地 RSV 季节性的给药时机的指导。虽然最佳给药时机是在 RSV 季节开始之前,但 nirsevimab 也可以在 RSV 季节期间对符合年龄条件的婴儿和儿童进行给药。
**注意:Nirsevimab 可用于有资格接受帕利珠单抗治疗的儿童。接受过 nirsevimab 治疗的儿童不应在同一 RSV 季节接受帕利珠单抗治疗。
呼吸道合胞病毒疫苗接种
(RSV [Abrysvo™])
常规疫苗接种
- 在美国大陆大部分地区,妊娠 32 周 0 天至 36 周和 6 天*:1 剂 RSV 疫苗 (Abrysvo™)。无论既往是否感染过 RSV,都应接种 RSV 疫苗。
- 建议母亲接种 RSV 疫苗或婴儿接种 nirsevimab(RSV 单克隆抗体),以预防婴儿呼吸道合胞病毒下呼吸道感染。
- 所有其他孕妇:不建议接种 RSV 疫苗。
目前没有ACIP建议在随后的妊娠中接种RSV疫苗。没有数据可以告知以后妊娠是否需要额外剂量。
*注意:RSV 季节性与美国大陆大部分地区不同的司法管辖区(例如,阿拉斯加、热带气候司法管辖区)的提供者应遵循公共卫生当局(例如 CDC、卫生部门)或区域医疗中心关于基于当地 RSV 季节性的给药时机的指导。
轮状病毒疫苗接种
(最低年龄:6周)
常规疫苗接种
- 罗塔里克斯:®2 个月和 4 个月大时的 2 剂系列
- RotaTeq:®2、4 和 6 个月大时的 3 剂系列
- 如果该系列中的任何剂量是RotaTeq(罗塔特克酒店)®或未知,默认为 3 剂系列。
补种疫苗
- 不要在 15 周 0 天大时或之后开始该系列。
- 最后一剂的最大年龄为 8 个月零 0 天。
破伤风、白喉和百日咳 (Tdap) 疫苗接种
(最低年龄:常规疫苗接种 11 岁,补种疫苗接种 7 岁)
常规疫苗接种
- 11-12 岁:1 剂 Tdap(青少年加强针)
- 妊娠:每次妊娠期间服用 1 剂 Tdap,最好在妊娠 27-36 周的早期。
注意:无论自上次接种含破伤风和白喉类毒素疫苗以来的时间间隔如何,都可以接种 Tdap。
补种疫苗
- 未接种 Tdap 的 13-18 岁:1 剂 Tdap(青少年加强针)
- 7-18岁未完全接种DTaP*:1 剂 Tdap 作为补种系列的一部分(最好是第一剂);如果需要额外剂量,请使用 Td 或 Tdap。
- 在 7-10 岁时给予 Tdap:
- 接受 Tdap 的7-9 岁患者应在 11-12 岁时接受青少年 Tdap 加强剂量。
- 接受 Tdap 的10 岁儿童在 11-12 岁时不需要青少年 Tdap 加强剂量。
- 在 7 岁或之后无意中服用 DTaP:
- 7-9 岁:DTaP 可计为追赶的一部分。在 11-12 岁时接种青少年 Tdap 加强剂。
- 10-18 岁:将 DTaP 的剂量计为青少年 Tdap 加强剂量。
- 有关其他追赶指南,请参阅表 2。
*完全接种疫苗 = 5 剂有效剂量的 DTaP 或 4 剂有效剂量的 DTaP(如果第 4 剂是在 4 岁或以上时接种的)
特殊情况
- 7 岁或以上且有 3 剂或更多剂含破伤风类毒素疫苗史的人的伤口处理:对于干净和轻微的伤口,如果自上次接种含破伤风类毒素疫苗以来超过 10 年,则给予 Tdap或 Td;对于所有其他伤口,如果自上次接种含破伤风类毒素疫苗以来超过 5 年,则给予 Tdap 或 Td。Tdap 是 11 岁或以上、以前未接受过 Tdap 或 Tdap 病史不明的人的首选。如果孕妇需要接种含破伤风类毒素的疫苗,请使用 Tdap。
接种水痘疫苗
(最低年龄:12个月)
常规疫苗接种
- 12-15 个月、4-6 岁时接种 2 剂系列疫苗
- 可进行 VAR 或 MMRV*
- 第 2 剂最早可在第 1 剂后 3 个月给药(至少 4 周后无意中给药的剂量可被视为有效)
*注意:对于 12-47 个月儿童的第 1 剂,建议分别接种 MMR 和水痘疫苗。如果父母或看护人表示偏好,可以使用 MMRV。
补种疫苗
- 确保 7-18 岁人群没有免疫证据有 2 剂系列:
- 7-12岁:常规间隔:3 个月(至少 4 周后无意中给药的剂量可被视为有效)
- 13 岁及以上:常规间隔:4-8 周(最短间隔:4 周)
- 使用 MMRV 的最高年龄为 12 岁。
儿童免疫接种时间表附录
COVID-19 和流感疫苗
|
COVID-19 和流感疫苗的儿童时间表附录 |
||
|---|---|---|
|
疫苗和其他 |
禁忌或不推荐1 |
预防 措施2 |
|
COVID-19 mRNA 疫苗 |
|
|
|
COVID-19 蛋白亚单位疫苗 |
|
|
|
流感,基于鸡蛋,灭活注射剂 (IIV4) |
|
|
|
基于细胞培养的灭活注射剂 |
|
|
|
重组注射液 (RIV4) |
|
|
|
减毒活流感 (LAIV4) |
|
|
- 当存在禁忌症时,不应接种疫苗。
- 当采取预防措施时,通常应推迟疫苗接种,但如果疫苗保护的益处大于不良反应的风险,则可能需要推迟疫苗接种。
- 疫苗接种提供者应检查 FDA 批准的处方信息,以获取最完整和最新的信息,包括禁忌症、警告和预防措施。其他疫苗
|
其他疫苗的儿童时间表附录 |
||
|---|---|---|
|
疫苗和其他 |
禁忌或不推荐1 |
预防 措施2 |
|
登革热 (DEN4CYD) |
|
|
|
白喉、破伤风、百日咳 (DTaP) |
|
|
|
乙型流感嗜血杆菌(Hib) |
|
|
|
甲型肝炎 (HepA) |
|
|
|
乙型肝炎 (HepB) |
|
|
|
甲型肝炎-乙型肝炎疫苗 (HepA-HepB) |
|
|
|
人瘤病毒(HPV) |
|
|
|
麻疹、流行性腮腺炎、风疹 (MMR) |
|
|
|
脑膜炎球菌 ACWY (MenACWY) |
|
|
|
脑膜炎球菌 B (MenB) |
|
|
|
脑膜炎球菌 ABCWY |
|
|
|
猴痘 [Jynneos] |
|
|
|
肺炎球菌偶联物 (PCV) |
|
|
|
肺炎球菌多糖(PPSV23) |
|
|
|
灭活脊髓灰质炎病毒疫苗 (IPV) |
|
|
|
RSV 单克隆抗体 (RSV-mAb) |
|
|
|
呼吸道合胞病毒疫苗(RSV) |
|
|
|
轮状病毒 (RV) |
|
|
|
破伤风、白喉和无细胞百日咳 (Tdap) |
|
|
|
水痘 (VAR) |
|
|
- 当存在禁忌症时,不应接种疫苗。
- 当采取预防措施时,通常应推迟疫苗接种,但如果疫苗保护的益处大于不良反应的风险,则可能需要推迟疫苗接种。
- 疫苗接种提供者应检查 FDA 批准的处方信息,以获取最完整和最新的信息,包括禁忌症、警告和预防措施。







